1.自己紹介
京都市JR円町駅近くの京都民医連中央病院と大阪難波駅近くの入野医院めまいセンターの2つの病院で「関西多発性硬化症センター」として多発性硬化症の専門診療をやっています。ここでは診療の他に、治療についての研究、新しいお薬の開発、多数の患者さんデータベースを作りデータ診断や治療に役立てる研究などをしてきましたが、最近私達は診療以外の研究や教育活動をするための非営利の社団法人「多発性硬化症治療研究所」を立ち上げました。
そうしたボランテイア活動の一環として、私達はインターネットによる多発性硬化症の医療相談・情報提供をするmsnet-japan.orgと、直接に電話で相談にのる「多発性硬化症電話医療相談」をやっています。090−2287−1021にお電話くださると年中対応しています。電話医療相談を受けますとその方の電話番号を登録し、もし受診されたら顔写真をいれさせていただきます。病気の経過や治療は何かなども書いて、後々また電話があった時に正確に相談にのれるようにしています。今後はこのMS友の会とも協力してやって行きたいと思っています。また、この講演会が終わって、この場で聞けなかったこと、あるいは後で思い付いたことなど、医療上の問題で聞きたいことがあれば、どうぞ、この電話をご利用くださればいいと思います。経済的な問題、行政的な問題、対人関係などは、友の会の方に相談していただきたいと思います。
私は30年以上に亘って多発性硬化症、視神経脊髄炎というふたつの病気を中心にした診療ばかりをやってきました。実は去年からiPhoneに変えたのですが、その理由は、普通の携帯電話では患者さんが1,000人までしか登録できないからです。現在1,500人くらいの方が登録しておられまして、うち1000人くらいの方は定期的に受診しておられます。北海道、対馬、石垣島、沖縄などからも来られます。
私は6年前まで宇多野病院という京都市の右京区にある病院で多発性硬化症の診療と病院長をやっていましたが、現在は名誉院長です。最近でもホームページには私の名前が載っているようですが、宇多野病院では全く診療はしていません。間違って患者さんがそちらへ行かれる事が未だあるようです。
2.多発性硬化症と視神経脊髄炎の区別と混乱
さて、この会では一言で「多発性硬化症」と書いています。しかし、今からの話では多発性硬化症(Multiple Sclerosis: MS)と:脊髄炎(Neuromyelitis Optica: NMO)と両方についてお話をします。その理由は日本では、行政や市民、医師以外は、多発性硬化症といっても視神経脊髄炎も含んでいるように使うことが、未だ非常に多いからです。
日本では多発性硬化症として難病対策事業の中に両方の病気が入っていまして、視神経脊髄炎が別だと言うと外される可能性もあるということもありまして現在でも行政的には一つの病気、多発性硬化症の中に視神経脊髄炎がはいっているということになっています。
ただ、世界的には、あるいは医学的・科学的にと言うべきかもしれませんが、二つ は明確に違う病気です。しかし、非常に似ているため、長い間区別が出来なかったのです。 明確に区別出来るようになったのは約10年くらい前です。当初は私もかなり迷い、2005年頃までは曖昧でした。今でも分離・区別ができない、一つの病気だと主張し、視神経脊髄炎の脳症状の無いタイプを視神経脊髄型多発性硬化症と呼んでいるグループもあります。しかしながら、大半の先生は現時点では私と同じ意見でして、視神経脊髄炎と多発性硬化症は似ているけれど違う、治療方法もまったく違うと考えています。
専門家と称する医師でもそうした混乱があり、専門でない先生が聞きますと良く分からないことになり、今でも多発性硬化症と視神経脊髄炎の両方まぜたような治療をやっていることがあります。それが非常に有害です。両方の治療は明確に区別する必要があり、注意が必要です。
私は講演の冒頭でいつも出席の患者さんに聞くんですが、皆様は自分が多発性硬化症か視神経脊髄炎か、ご存じでしょうか? ここにおられる方は多分ご存知だと思います。京都や大阪では私は何度も繰り返して区別することの重要性を言ってきました。ただ、単に多発性硬化症であるということだけではなく、視神経脊髄炎ではないということを言われているかどうか。あるいは視神経脊髄炎であって多発性硬化症ではないという言い方をすることが今では必要と思いますが、そういう形でもう一方ではありませんよというような説明を聞いているでしょうか。ちょっと手を上げていただけますか?あのそう明確でないという方がおられましたら。多発性硬化症でも、視神経脊髄炎ではないということを聞いておられない方、視神経脊髄炎と聞いているけれど、多発性硬化症ではないよということを聞いてないと言う方おられませんか?
京都は先進的で、聞いている方の割合が高いです。全国どこへいって講演しましても、かなり曖昧でそういうことは聞いたことがないと、昔から多発性硬化症と聞いているだけの方が多いです。そうした患者さんのお話を聞いてみると、どうも視神経脊髄炎みたいだなと思う事があります。Dr.が知っている場合でも説明しない事があります。また、Dr.自身が患者さんがどちらであるか自信がない場合もあります。京都や大阪ではあまりそういう方はおられないと安心しています。
3.多発性硬化症と視神経脊髄炎の共通点:中枢神経の自己免疫疾患
まず多発性硬化症と視神経脊髄炎がどう違うか、どう似ているのか、簡単に説明します。いずれも中枢神経の免疫異常で起きる病気、自己免疫疾患である点が共通です。
中枢神経というのは、脳と、脳の下に長い鉛筆くらいの太さで腰のあたりまでぶら下がっている脊髄、それに視神経の3つから成り立っています。視神経は細い紐のように脳と目の玉の後ろを繋いでいる突起です。細い紐みたいで末梢神経に似ていますが、視神経は例外でして、中枢神経です。一方、体中に末梢神経がはりめぐらされていて、例えば顔面神経など、脳の命令で筋肉を動かしたり、皮膚の感覚を脳に伝えるために繋がっていて末梢神経と言い、中枢神経と区別されます。
もう一つ共通しているのは、どちらも免疫の異常で起きる自己免疫疾患である点です。免疫というのは、通常、細菌やウイルスが自分の身体に侵入してきた時、異物と認識して、破壊して体を守る仕組みです。全ての生き物が免疫機序を持っています。
自己免疫というのは、自分自身の身体の一部分を異物、即ち、外界からはいってきた攻撃すべき対象、自分の身体の一部分ではない物体と間違って認識してしまう。そういうことが起きますと、自分を守るはずの免疫が自分の身体の一部分に対して、異物であると誤認して攻撃するようになる。そうした異常な免疫の状態であり、自己免疫疾患が引き起こされるわけです。
自己免疫はいろんな細胞に対して起きます。関節の滑膜細胞を攻撃するようになり起きるのが関節リウマチ、膵臓のインシュリンを作る細胞に対して起きますと1型糖尿病、男性の精子に対してそういうことが起きますと男性不妊症。甲状腺に起きますと、甲状腺炎、甲状腺機能亢進症あるいは低下症などが起きます。ほとんどあらゆる臓器の細胞にこういうことが起きるんです。
4.多発性硬化症と視神経脊髄炎の違いは攻撃の標的細胞
脳などの中枢神経に対してそういうことが起きて生じる病気は多発性硬化症のみだと、かっては思われていました。ところが最近になって、視神経脊髄炎という別のモノがあると解ってきて、その違いがだんだんはっきりしてきたのです。両者の根本的な違いは、攻撃される中枢神経の細胞が異なる、攻撃の標的となる細胞の分子が異なる点です。
5.多発性硬化症の攻撃対象:オリゴデンドログリア
即ち、多発性硬化症で攻撃されるのはオリゴデンドログリア(乏突起神経膠細胞)とそれが作る「髄鞘」膜構造で、その構造タンパクが標的です。一方、視神経脊髄炎で攻撃されるのはアストログリア(星状神経膠細胞)であり、その細胞膜のアクアポリン4という水チャンネル分子が主な標的です。
多発性硬化症で攻撃される髄鞘は英語でミエリンとよばれ、細長い神経繊維の周りを何重にも囲む膜構造です。神経細胞はコンピューターの中のチップみたいなモノでして、本体の細胞があり、そこから長い突起を出して、次のチップに接触し情報を伝える。神経細胞の突起は軸索とよばれ、電線のなかの銅線みたいなもので、電気の流れを伝えることでネットワークを作っています。人間の脳の中は長短さまざまな長さの神経繊維が非常に複雑なネットワークを作っていて、コンピューターの様に情報処理をしています。ボールを蹴ろうとか歩こうとかいろんな命令を脳から出して脊髄に伝え、さらに末梢の運動神経に伝え、筋肉を興奮させてボールを蹴ることができます。その中心になるのが神経細胞とその突起の軸索です。
髄鞘・ミエリンは神経細胞の突起の軸索が電気の命令を正確に早く伝えることを可能にする構造です。命令の電気活動が途中で漏電したり、あるいは途中で電気信号がだんだんだんだん弱くなって遠くまで伝えられないということが起きないように、電線のビニール被膜と同じように神経軸索を何重にも取り巻いています、この髄鞘・ミエリンを作り維持しているのがオリゴデンドログリアです。オリゴというのは稀な、少ないと言う意味です。デンドロと言うのは突起。突起が比較的少ないグリアという意味です。
6.視神経脊髄炎の攻撃対象:アストログリア
グリアというのは膠(にかわ)細胞と書き、神経細胞の間を埋めている細胞の意味でつけられました。脳の中の神経細胞と神経細胞の間を埋める神経細胞ではない細胞。昔発見され時には訳がわからん、間を埋めている、膠のように間を詰めている細胞だと考えられ命名されたのです。
実は、グリア細胞には数種類あるんです。一番数が多いのはアストログリア細胞。これも何をしているのか解らなかったのですが最近では良く解ってきました。神経細胞が栄養を血管から貰うときにこの細胞を伝わって受け渡しをするようなこと、あるいは水を受け渡す、電解質を受け渡す。神経細胞が生きていくのを支える、どうしても必要な細胞。それがアストログリア細胞です。アストロとは星、空の星をアストロと言いますね。宇宙戦艦大和の歌にもありますね、アストロのなんとかとか。
星状のグリア細胞、突起の多い細胞です。これに対し突起の少ない細胞がオリゴデンドログリアです。これらが非常に重要な2種類のグリア細胞です。多発性硬化症で攻撃されるのはオリゴデンドログリア細胞です。もう一方視神経脊髄炎で攻撃されるのは、アストログリア細胞です。どちらも神経細胞ではないグリア細胞が免疫の異常で攻撃されるのですが、グリア細胞の中の種類が違う細胞が攻撃されることで、2種類の病気が起きる、それが基本的な違いだということが解ってきたんです。
7.視神経脊髄炎の標的分子:アクアポリン4水チャンネル
視神経脊髄炎の場合に攻撃されるものは、アストログリア細胞の突起の先端の細胞膜にあるにアクアポリン4水チャンネル分子が主な標的の分子であることがわかっています。アクアポリンは水分子を細胞の内外に通すタンパク分子です。アクアとは水、ポリンとは穴の意味で、細胞の膜にあるこの分子を通して、水が容易に細胞内外へ移動できるようになっています。これを発見したアメリカ人化学者が2003年にノーベル賞をもらっています。
細胞によってアクアポリン分子の種類がいろいろありまして1番から16番くらいまですでに解っていますが、そのなかの4番が神経のアストログリア細胞に特別に出てくる分子です。この分子はアストログリア細胞の表面に一様に出ているのではなく、アストログリア細胞の突起が血管にくっついているところに集中的に存在しています。
この部分をとおして血管の中から効率よく水を吸い込んで、アストログリア細胞の中に蓄え、さらに神経細胞に水分を受け渡しする。そういう水の通り道のチャンネルです。視神経脊髄炎では、このアクアポリン4分子が攻撃される。この分子はアストログリア細胞という細胞にしかほとんど存在しませんので、結果としてアストログリア細胞が破壊される。それが病気を起こすということが解っています。
8.視神経脊髄炎の臨床的特徴:脊髄の長い病巣の出現
視神経脊髄炎ではどんな臨床的な特長があるか。多発性硬化症と比較しての話ですが一番の特長は脊髄にMRIでみえる長い病巣がでることです。こういう観察が可能になったのは1990年代後半からでして、それまでのMRIはそれほど性能も不十分で明確に見えなかったし、MRI機器の普及も不足していました。私自身もMRIは1980年代に日本に最初に入ったころからMSの診断に使いましたけれど、脳以外を撮ってもあまりきれいに見えなかったんです。
それがだんだん性能が上がってきまして、90年代の後半からはっきりと見えるようになってきました。1999年にアメリカのメイヨー・クリニックの先生達が、視神経脊髄炎は脊髄の長い病巣があることで多発性硬化症の患者さんとは区別できると報告しました。そのときにはさっき言ったアクアポリン4というのはまだ発見されていなかったんです。2004年になってさっき言いましたアクアポリン4に対する抗体というものが視神経脊髄炎の患者さんの血液中にあることが発見されまして、新しい診断が可能になりました。メイヨークリニックにいるバンダ・レノンというオーストラリア出身の基礎研究者の発見です。こうした基礎的な研究結果を早く臨床に取り入れる研究が大きな成果を生みました。
9.視神経脊髄炎(NMO)診断のポイント
どうやって視神経脊髄炎NMOの診断をするかというポイント。これは私の意見でしてまだ世界中共通の意見にはなっていません。臨床症状が特徴的だとして重視する診断基準が出回っています。私は臨床症状ではほとんど区別ができない患者さんが沢山いるので、他の客観的基準のみで区別する方が良い、十分であると考えて実際に用いています。 海外では目が一回だけの悪化で視力が0.1を切るような人は多発性硬化症ではないんだというようなことを言います。私は何人か多発性硬化症でもそういう患者さんがおられることを知っていまして、そういうことでは区別できないと思います。
それから1回だけの脊髄炎で、たとえば車椅子になってしまうような方、こういうことは多発性硬化症ではほとんど起きないと。それはある程度事実ですが、そうした患者さんは少ないですし、特に、最近は早期の治療をしますと、ほとんどありませんので、区別に役立ちません。MSとNMOの決定的な違いは、MRIで脊髄中心部を連続して占める長い病変が見付かるかどうかということ、もう一つはアクアポリン4に対する抗体が血液の中で見つかること、この両者です。このうちどちらかがあれば、それだけで絶対に多発性硬化症ではないと診断をつけることが可能です。こういうやり方で区別し治療していますと、2つの病気が治療に異なった反応をすることが良く分かります。
10.視神経脊髄炎での抗アクアポリン4抗体の出現
私の視神経脊髄炎の患者さんでしらべますと、抗アクアポリン4抗体陽性の方が85%です。また95%くらいは特徴的な長い脊髄病変がでる。
まだ良く分かっていないのは抗体が出ておられない15%の方です。多発性硬化症を疑い、抗アクアポリン4抗体陰性であった場合、抗体陰性の視神経脊髄炎なのか、それとも多発性硬化症なのかを区別するためには脊髄のMRIが決定的に大事です。この為にはMRIを適切な時期に、適切な方法、技術で撮ることが非常に重要です。特徴的な長い病巣は、しばしば一時的に出て消えてしまいますので、撮るべきときに撮らなかった患者さんは、その後の診断が難しくなって間違われてしまうということがあり得るんですね。
自分の足や手、特に足の症状などがもっとも強かったピークの時にMRIを撮ってあるかどうかということが非常に大事になります。だから患者さんが他所から来られた時には必ず、過去のもっとも強かった時のMRIを前の病院へ行ってなんとか貰ってきてくださいとお願いします。 一番強かったときに長い脊髄病巣の出現が無ければ、まず視神経脊髄炎ではありませんよと言えます。沢山の患者さんの中で、まれに初期には暫くの間、数ヶ月の間、迷うことがありますが、必ずどちらかに区別が可能ですし、はっきりと違う治療方法で治療することになります。
11.視神経脊髄炎の治療
まず視神経脊髄炎の治療についてお話します。スライドは一枚だけです。なぜかと言うと視神経脊髄炎の治療はやさしいのです。多発性硬化症に比べだんだんそう思うようになりました。診断さえ正しく、正しい治療さえ行えば、視神経脊髄炎の治療中に障害が進んだ方はほとんどいません。この7年間で私の視神経脊髄炎の治療をしておられる方の中で、再発は若干起きる方がありますけれどほとんどそれは戻ります。一歩障害が進んでしまったという方はほとんどありません。死亡された方は無論ありません。他の病院に入院しておられて死亡された話を聞きますが、診断や治療方針が間違っているのだろうと思います。治療の中心は免疫抑制剤を利用することです。これは日本では一般的ではありません。アメリカでは私とほぼ同じ意見です。
メイヨー・クリニックを中心とした欧米では、視神経脊髄炎の再発の直後でない患者さんが来たら、プレドニン、ステロイドはまったく使いません。免疫抑制剤だけでスタートします。日本ではそういうことはほとんどの医者がやりません。プレドニンを長期に投与して、それでも抑えきれなかったら、あるいは副作用で使えなくなったら、やむをえず免疫抑制剤を使うという、違う治療方針が用いられています。大量に使えば効果はありますが、大きな問題は副作用です。日本での、こうしたステロイドのみに頼る治療は間違っていると思います。特に注意して欲しいですね。
12.ステロイド、プレドニンの副作用
プレドニンを長期に使っていますと様々な副作用が出てきます。大量のプレドニンを使えば効果は非常にあります。少量では再発がかなり起きます。しかしながら長期に使えば副作用が非常に問題になってきます。
東京から1週間前に歩けなくなったと言ってこられた、視神経脊髄炎の診断を受けている患者さんがありました。61歳の女性で歩けていた方が歩けなくなって、MSの専門医のところへ行ったら再発だと言われ、入院してパルスを2クールやったが、改善が無いので、次は血漿交換だと言われているとのお話でした。診察をすると歩けないのは主に腰が痛むからでした。痛む場所をしらべると、腰の骨の横あたりで、股関節が痛いのであり、再発ではないと思うということを申し上げて、整形外科の診察を受けることをすすめました。そうしますと、昨日電話がありまして整形の先生がMRIを撮って大腿骨骨頭壊死と診断したとのことでした。大腿骨頭壊死というのはプレドニンを使うことによって起きる一番問題になる副作用です。
また、九州からきて現在入院しておられる視神経脊髄炎の女性は両眼失明で寝たきり、気管切開を受けており、非常に重症の糖尿病と肥満がプレドニンの副作用でおきている。長い間、プレドニンだけで治療されてきた方です。良く聞きますと、視神経脊髄炎で一眼が失明したのですが、もう一眼は副作用の糖尿病性網膜症で失明している。また、糖尿病性の腎症で生命が危うい状況でした。プレドニンを次第に減量し、免疫抑制剤を用い、糖尿病や肥満も少しずつ改善しつつあります。他にも他院でステロイドを大量に使用され、脊椎の骨折を起こし、歩けなくなって、転院してきた人をたくさん見ています。
ステロイドの副作用で一番多いのは肥満、糖尿病ですね。次に骨訴訟症で骨が折れるということ、他にも動脈硬化、高脂血症、心筋梗塞や脳梗塞の増加、感染症が増える。白内障、緑内障が増える、皮膚の発疹やにきびのひどいのがでるなど、ちょっと覚えきれないくらい副作用が沢山あります。
京都で今日見ていますとあまり肥えた方はおられませんが、東京や仙台などでの患者さんの会に行ったら、ぱっとみたら病名が分かるんです。だいたい肥えて満月の顔をしておられ、あ、この方は視神経脊髄炎でプレドニンをのんでいる方だなと。男女比で視神経脊髄炎は女性が10、男性が1くらいで非常に女性が多い病気で、ちょっと年輩の方に多い。
13.視神経脊髄炎の免疫抑制剤治療法
免疫抑制剤というのは沢山種類があり、ほとんどの免疫抑制剤がNMOに効きます。ただ、神経内科のDr.は使い方に慣れておらず、間違っていることが多いですね。
例えばイムランというのが良く使われますが、これは6ヶ月くらいかかって効果がでてくる。ところが2.3ヶ月使って再発があったからこれは効かないと、さっさとやめてしまう。こういう例が多いです。イムランは一定程度効くことは効きますが、効果の発現に時間がかかる。アメリカはイムランを中心に使っているのですが、私が使っているプログラフ、あるいはミゾリビンなどに比べ、長期に使っても再発率が高い。しかも副作用も多い。私は勧めませんが、日本でまず免疫抑制剤というとプレドニンで失敗したらイムランを使うのが常識です。
他にもネオーラルというお薬も良く効きます。ネオーラルもプログラフと良く似たお薬ですが、少し使いにくい。副作用で腎障害が多い。プログラフも腎臓が悪い方で、それを見過ごして利用しますと危険性があります。腎障害がある方で使い続けると腎障害がさらに悪化すると、これがプログラフの唯一の欠点です。
ミゾリビンはプログラフに比べるとやや効果が低いですが、非常に安全です。私は長年使っていて副作用の経験がないです、ただ、プログラフの方が少し切れが良いと思います。こういうものを主に私は使っています。
他にもメソトレキセートとか、アメリカではイムランがだめだったらマイコフェノール(ミコフェノール?木下)が使われます。マイコフェノールは日本では移植にしか使えないので保険では使いにくいです。エンドキサンも有効です。
免疫抑制剤を使う場合は、私は6ケ月くらいでプレドニンを止めます。昔は2年間くらいかかってストップしました。かってはストップしても大丈夫かもう一つ自信が無かったのです。最近、アメリカではプレドニンを最初から使わないというやり方を基本的に用いているということを聞いて、だんだん使用を短くし、最近では新しく始める方は半年くらいでプレドニンを完全に中止しています。それでも同じような効果がでていますのでもっと短くできるかもしれないなと思っています。確証がないので、少しずつ短くしようかなと思っている段階です。
視神経脊髄炎についてはそれぐらいにしましょう、ここから多発性硬化症。 ここは過去の歴史世界的な歴史、現時点で多発性硬化症の治療薬がどれくらい開発されたか成功したものをずらっと一覧にしました。

日本でも使われているインターフェロン・ベータ1b、ベータフェロンが93年から、日本では使えていないコパキソンというもの、それからアボネックス 日本で2番目に使えるようになった現在も使われているインターフェロンですね。黄色い3つが日本で使えるものです。 日本で使えないものが10種類、全世界では現在10種類、うち3つが日本で使えると。ギャップがだんだん大きくなってきていると。非常に大きな問題なんです。恒に後れているのですが、このフィンゴリモド、ジレニアだけは日本が京都大学が開発して田辺三菱が特許を持っているというお薬でしたので、日本とアメリカとの差が約1年で済んだんです。平行して治験をすることができた。
しかし、その他のお薬は海外で成功して利用されるようになってしばらくしてから日本にも持ってこようかなあというそう言う順番になりまして、それもですね最近だんだんに難しくなりつつあります。なぜかと言うと、患者さんが多くない、日本は欧米に比べて。人口あたり20倍の差があるんです。
現在多発性硬化症は日本では1万人に一人くらいと言うことです。海外ではその20倍おられますね、白人の世界では。非常に重要なだれでもが知っている病気ですから、日本では普通の方はほとんど知らない病気ですね。まあそういうこともありまして日本では開発はなかなか難しい、それがますます、すでに3つある中で次、4番目のお薬、5番目のお薬と患者さんの数は徐々に増えてはいるんですが、やはり海外にはとても及ばない中で会社が開発にお金を投じても回収できなくなりつつあるので、躊躇するようになる、ますますそういう傾向がでてきてまして大きな問題です。
こういう場合は制度を、やはり制度を考えなおさなければならないと思います。どういう風にして、治験を沢山の何百人もの患者さんでのテストが日本ですべての薬に必要だということをいつまでも固執していくべきではないのではないかなあと私は思います。
その他にですね、ちょっと名前はあげてもだめなんですが、いろんなお薬がすでに海外で使われておりまして、10番目が今年春に出たという段階でしてこのうちのいくつかは、新しい日本で治験がはじまった、まあごく最近にはじまったということを後でお話します。
多発性硬化症の一般的な経過でして、最初に初発の時に悪化したときに多くの場合はそれ以前にMRIでもし撮ることができれば、たまたま撮ることができれば先に活動がはじまっている。
多発性硬化症は水面下で再発が繰り返して起きているんだけれどご自身では気がつかないのが特長です。ということはかつては知られて無かったんですね。現在でもあまりDr.はそういうことを強調しないというか、Dr.自身も御存じないDr.が非常に多いですから、年に一回だけMRI撮るとか、再発があった時だけMRI撮れば良いという風な考えでやっておられる方が多いんですけれどそれは間違いです。
私の患者さんでですね、この2年間ぐらいの間に2年ぐらい前に4人くらい一卵性双生児の一人が多発性硬化症で皆女の人ですね、こられまして、不思議なんですけれど急に去年と一昨年、一年間に4人くらいかかったですね。 まあ、過去2、30年間私がやっていてそういことは一人も来なかったのにそういうことがあったのですがそれはともかく、世の中がそういう偶然というのがいっぱいあるんですけれども。
一卵性双生児ということは最初は言われなかった、途中で聞いてじゃあもう一人の人を調べた方がいいよと、それは理由がありまして、海外ではですね、だいたい一卵性双生児であれば3割3分くらいもう一人の人に多発性硬化症があると言う沢山の研究があるんです。
日本ではほとんど一卵性双生児について発表した人はだれもいないんですね。私の患者さん、そうやってもう一人の人を連れてこられて、もう一人の人で診断がついた方は一人もいません。ですが、来ますと診察したら少しおかしいという点が見付かる方もおられます。それから、一人の方はまったく正常です。ご本人も健康と思っておられるのですが、MRIを撮りますと脳には病巣がもうすでに数個でておると、自身は何も気がついていないというタイプがありましてちょっと不思議なのは私の4人の患者さんは全員4人が多発性硬化症がすべてある、一人は症状がまったく今もでておりませんが、MRIでは見えているそういう方ですね。
そういう風にMRIでは活動があるけれど、御自分では何もわからないというのが非常に特長でしてそういうのが知らない間に進行しているということがありますのでMRIを定期的に撮ることが大事であると。
そういうことをやっていますと、だんだん再発というのが減ってくる、徐々に。10年20年経ちますと。しかしながら問題はですね、それまでに積み重なった神経線維の障害、神経細胞が一緒にやられることが非常に問題でして、その結果神経細胞がだんだん弱ってきていろんな障害が現れてくる。例えば後遺症が現れてくるのは神経細胞が壊されたから起きるんです。後でそのへんのお話がありますが、こういう風に症状がはっきりと進行しだす前に治療をしっかりすることが大事だということが最近のいろいろな研究で明らかになっています。
これは治療が無かった時代ですけれど、15年経った時に約半数の方が日本でもカナダの研究でも、日本で私が宇多野病院でやった研究でも、15年目くらいでだいたい半数の人が杖一本それから20年経ちますと半分の人が車椅子。半分の人がということはそれより重い方もおれば、全然なんの症状もまだないという方も15年経ってもおられることはおられます。
ま、平均がその程度だという非常に個人差が大きいと言うのも特長ですがただ、良性多発性硬化症という方もあることはありますが、最初に2回か3回だけ再発があってその後ずっと何も起きていませんとMRI撮ってもほんとうに何も起きないとそういう方もおられます。が、そういうことをあまり期待するのは間違っている。
そうだと言うことが証明できるのは後になってからしか証明できませんからその%と言うのはあまり高くありません、というのは治療しないでうまくいくという割合はですね。 視神経脊髄炎でもですね、15年間なんの治療もしていなくても再発が起きて無いかたが私の患者さんがおられますが、そういう方もありますが多くの方はそうではありません。
やはりこういうグラフを見ますとですね、再発の数と、初期の再発の数と進行速度にかなり違いがある。最初の2年間の再発の数というものがやはり先々を見る上で重要だと。あるいは最初の2年間の脳のMRIの数がかなり重要だとかこう言うようないろんなデータがあります。 そういうものが多ければやはり治療を、よりしっかりした治療をする方が良いと言うことが言えます。
それからこれは2年前ぐらい前に発表された大事な論文でして、インターフェロン・ベータ1bが1990年くらいからカナダとアメリカで治験というのが始まりまして、現時点で23年ですが、そういう患者さん、治験が始まった時から治療を受けた患者さんが21年間経ってどうなったかということを調べた研究でして、非常に重要な点はですね最初の2年間3つのグループに別れたんです、この人達は。
一つはにせ物が2年間当たった人、1/3ずつインターフェロンが多い量と少ない量があたったこの3つのグループが2年間ありまして、2年終わった時に、全員が本物のお薬があたるようになったんです。
治験というのはほんとうに、残酷と言いますかにせ物があたった人は2年間非常にかわいそうなんですけれど、そういうことがないとこのお薬がほんとうに効くということが証明しようがないのですべてのお薬でこういうことがされます。
そういう方のおかげで薬が使えるようになっているんですね。ただ、この場合は2年間経てば、経った次点で初めてこのお薬が効くということが証明出来ましたので、全員にこれを利用しようということになった訳です。
でその後ほぼ同じような治療を19年間、合計21年間治療を受けてまして、そのうち98%がアメリカ中の施設ですが、全部を丁寧にひとりひとりを追跡してですね、事務所変わったりアメリカなんか日本以上に移動しますから大変な研究なんですが、98%追跡できた。
その人達が、21年後にどうなったか、ということを調べて一番ショッキングだったのは多発性硬化症で無くなった方の差がある、このグループの間で。最初の2年間が違うだけなんです。
にせ物があたっていた人達は本物が当たっていた人達にくらべて死亡率が倍だったと、21年間の間に、多発性硬化症ですね。こういうことはあまり予期していなかった。少し差があるだろうと例えば車椅子になっている人が多いのじゃないかと、そういうことが見付かるのではないかと思っていたのですが、死亡率にまで差があったということは非常にびっくりするようなデータでして非常に重要な結果です。
これで、一つ言えることはやはり、比較的患者さんが、重い患者さんも入ったのですが軽かった患者さんが多いんですね、治験に参加した人は。比較的初期の人達がその人達で大きな差が出てまして、治療の初期に本物が当たりますとかなり効果が高いということですね、そういうことがこの死亡率に影響してきておると、初期での治療の差というものに大きな影響を受けたという風に考えてられております。
こういうことがありますので、いままでは2、3年間例えばインターフェロン使って何か問題があれば次の薬に切り替えると、こういう治療です。これは今でもそういう治療が普通の考え方ですが、それは必ずしも正しくないのではないか、安全でさえあれば出来るだけ強力な治療を早くからする方がいいんじゃないか。効果がある時期というのは、比較的初期だと、病気のですね最初の10年間とかですね。だんだん効果が無くなるわけではないけれど、次第に初期の10年間と次の10年間の発病からの期間を考えますとですね、有効性に差が出てくると、だんだんと差が出てると。だんだんといろんな研究でわかってきていまして、自分は今のところ歩行障害がないからいいのだろうというのは必ずしも正しくない可能性があるということです。
ここからひとつひとつ具体的な薬についてお話しますが、一番の最近のトピックスは御存じのように飲み薬が出た。さっきも言いましたようにこれは京都大学の藤田先生という先生、もう名誉教授で80歳くらいの先生ですが、25年くらい前に台湾セミの背中に生えているこういう苔みたいな冬虫夏草、ふゆむしなつくさと書いて漢方薬になるんですけれど、これはカビみたいなものですが、そこから抽出した化学物質これが免疫抑制効果があるということをみつけまして、それをさらに安全でさらに効果が高いものというもので、これをいろいろと名を変えまして化学合成で類似しているけれど違うものでフィンゴリモドFTY720というものを合成しまして、これを田辺三菱が特許を持っているのですが。
日本で多発性硬化症の薬の開発がなかなかできない。それだけの総合的な力がないんです
国際的な会社ではないんですね、田辺三菱というのは。それでスイスのノバルティス、製薬メーカーにIBMとかですねそれからエプソンとかいう、すべての企業を併せたなかのトップ企業の中でも5番目くらいの、世界のノバルティスという会社ですね、そういう会社に特許を漏出してノバルティスが多発性硬化症のお薬に成功したというのが約2年前の話でして、一日一回カプセルを飲んでいただくということで有効だと言うことです。
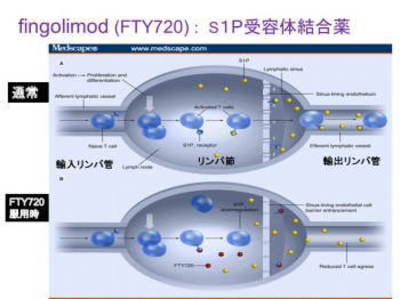
なぜ効くかということですが、上が飲んでいない方、下が飲んでいる方と思ってください。飲んでない方ではですね、人間のリンパ球というものは98%はこのリンパ節の中で休んでいるんです。1.5%だけが出て行って、体中を廻ってまたその全部ではないけれどかなりの部分はもう1回帰ってきてまた休んで出ていく、だから、人間の血管の中にはわずかなリンパ球が廻っているんですが、ほとんどはここで休んでいるんです。
この休んでいるときに出ていく時に働く、黄色い分子、これは身体の中の脂なんですが これがくっつくと、出て行けるようになるんですが、フィンゴリモドというお薬は黄色いやつがくっつくはずの予定のこの細胞の膜のところに前にくっついてしまう。この黄色いのはくっつけなくなる。くっつけなくなると表に引っ張り出されないので、このリンパ節の中に留まってしまう。出て行かなくなる。
そういうことで、このお薬を飲みますと暫くすると、血管の中のリンパ球が正常が100だとしますと30位まで70%減るんです。そういうことが効果がでてくるんですが、そういうことによって、リンパ節の中にあって脳や脊髄を攻撃しに行くための免疫の異常の中心になっている細胞が出て行けなくなる。だから、攻撃できなくなる、それによって炎症が減るということが考えられています。わかったでしょうかねえ。
後でお話しますがこのリンパ球に対する効果とは別に脳のさっき言いましたグリア細胞、あるいは神経細胞に対しても直接にこのお薬は働くということもあります。リンパ球が減ると感染症が増えるのではないかと、これはいままで同じような他の血管の中のリンパ球が減ったお薬では、多くのお薬でそういうことが観察されておりますので、最初は非常に恐いと言いますかそういう、危惧されたのですね。恐る恐る使った。リンパ球がそれだけ減っていれば感染症が増えるんじゃないか、死亡する方が出てくるのではないか、ということが考えられまして、まず最初は健康な方に飲んでいただいたけれど特に感染は増えないようだということで次は多発性硬化症に使って、というような順番でやったのですが、もう現在わかっているのはリンパ球の数が減ってもこのお薬でもやはり2年間にせものを飲んだ方がいるんです、数年かかってやったのですが、本物が二種類、多い量、少ない量を飲んだ方で感染症の頻度、あらゆる種類の感染症を集計して2年間の間で差はない、むしろにせ物がほんのわずかに多い、これは誤差ですけれど、ほとんどどのグループも差がない、それから、リンパ球があまり減らなかったのが右側非常に減った方が左側ですね。
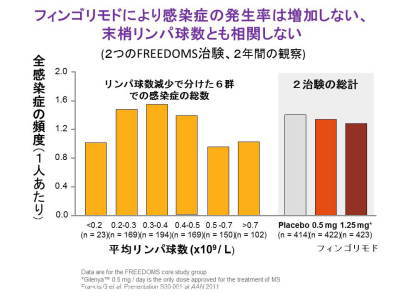
その減った程度によってグループ分けをしてみても、感染症は差がないと。もう一つですね効果の方も差がないと、リンパ球の数というものと直接の関係がないリンパ球の中にはいろんな種類がありまして、その特定の細胞が出て行けないということが、多発性硬化症に関係しているのであって、これは全体の数ですので全体の数自身はあまりみても大した意味はないし大事なことは感染症はこの結果として増えていないということが分かりました。
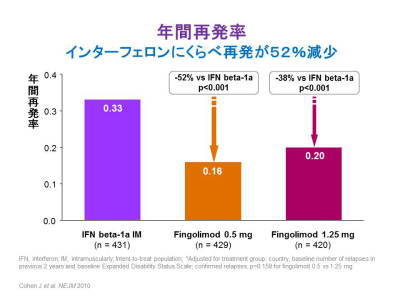
これが効果でして、これは再発、年間の再発率ですがこれはにせものが当たった人達の再発率に対して、フィンゴリモドというものがあたった方は54%、あるいは60%程度再発率が減ったと。
これまでの多発性硬化症の標準薬はインターフェロン・ベータ1b,あるいは1aなんですが、この場合は30%くらい減ると減り方が。
それに対してまあ約2倍程度減ると、後で紹介しますタイサブリというのは70%くらい減ると、ここで10%簡単に私が言っているのは、飲み薬フィンゴリモドは約2倍の効果、タイサブリは約3倍の効果ということを申し上げています。ですから、まったく再発がこのお薬を飲み始めてから起きていない方もありますが、たまに時々起きる方もありまして、これは平均値での話です。
もう一つ大事なのは、このお薬を私、現在までに260人の患者さんに飲んでいただいています。インターフェロンを使っておられる方ももちろん中にはいるんですが、比較してみますとインターフェロンではだめだった人でこちらへ移行した方では、ほとんどの方ではうまくいっていまして、ただし、インターフェロンでだめでこちらにきてもどうも効果が不十分だなあという方も少しおられまして、そういう方のうちの3人の方にもう一回インターフェロンに戻っていただいたんです。戻っていただきますとですね、ほとんど全員が3ヶ月くらいでまた激しい悪化であわててまたこちらに戻したんです。
だから今までの私の経験ではインターフェロンのほうが、この方にはインターフェロンの方が いいなあと言う方は一人もいません。絶対にないとは言えませんが一人もありません。ですから、なかなかこのお薬は優れているなあと思っています。
先程は薬を使った人と使わなかった人の差です。今度はインターフェロンを使っている、今の週に一回のインターフェロンとの比較ですが、それと比較してもだいたいこのお薬は一年間インターフェロンを使い続けた人とそれから切り替えた人の比較です。 再発の頻度が半分くらいに減っています。こういう再発というのはですね、判定が非常に難しくてこういう治験でも僕はそれほど正しくない、医者が判定するんですが、医者自身の判定にかなり僕は間違いがあると思います。
これは、この患者さんの今言っておられることを再発だと判定するかどうか非常に迷う場合が結構多いです。私も何十年かやっていてもそういう方が結構、そういう場合が多いですがこれはあまり経験のない医者も参加して全世界で、あるいは日本ででもですねやりまして、かなり間違いを含んでいると思います。実際はもうちょっと少ないのが本当だと思います。どちらの場合でも、にせ物の方でも。私がその後使っていてですね、これよりもっと少ない。実際、実感としては。特にMRIで確認できるような再発に限りますと、非常に少ないです。
それからこれは私が現在では5年になりますが、治験の最初から半年経った次点で、このお薬を飲んだ方は35人おられまして、その中で妊娠したり、あるいは肝障害がでたり若干のそいういうことで止められた方がありまして、肝障害が出たというのはその、そんなに重い肝障害が出た方はいないんですが、この取り決めがありまして止めさせられた方がおられますが。そういう方は脱落したことも若干ありますが、33人が4年間続けて飲んでおられまして、その間にですね、スタート時点で障害度が2、平均ですこれは、が1ぐらいにまで約半分くらいに約3年半経ちますとそれぐらいにまで減っていると。だから障害がゆっくりと改善していると、こういうことが今までのお薬ではインターフェロンではほとんどあり得なかったことでして、効果が高いことの一側面。こういことも出てきています。私自身の経験です。
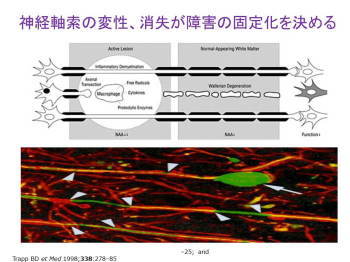
次に話を同じ薬の効果ですが、神経線維に対する効果というか、話を移します。多発性硬化 症の患者さんはここに病巣が出ています。同じ神経線維から突起が出ていますと周辺部で は神経線維は切れないのですが、真ん中の炎 症が激しいところでは切れてしまいます。切 れてしまいますと、この神経線維は二度と戻りません。
これは非常に残念ですが、人間の中枢神経は現状ではそういういことになっていまして一生に一本この神経線維は、神経細胞は一回だけ突起を伸ばして、もし切断されますとこれがもう一遍伸ばすということができないのです。これは再生医療で将来できるようになるかも知れませんけれど、現時点ではまだできません。ですから、こういう切れると言うことが後遺症を残す原因です。 切れないようにすれば良いんですが、なかなかこれが、これを切れないようにするための唯一の現在持っている唯一の方法は激しい炎症なくすると。そのためにリンパ球の攻撃が減るフィンゴリモドは役立つのですが、すでに切られている場合どうしたらいいか。
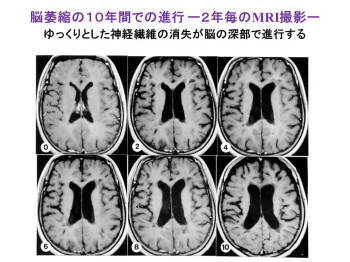
これを神経線維そのものに直接働くような効果 がなけばなかなか回復は難しいと思われるので すが、このフィンゴリモドはそういう効果もある のではないかとある程度考えられております。 それはですね、これはいつも見せているんです が姫路からこられて10年くらい前もインター フェロンが使えるようになる前の話ですが、 だんだん10年間の間に神経線維がやられたた めに、脳が萎縮していったという経過ですね。 これは皆が起きる訳ではないですが、ある程度患者さんの中の一定の割合でこういうことが起きると。これはインターフェロンを使う前の話ですので、使えばもうちょっとこんなことは無いんですけれども、こういうことが起きないようにするのにどうしたらよいかということで、この新しいお薬フィンゴリモドは期待が持たれています。
それはなぜかと言うと、神経細胞に対してもこのお薬が直接働くという証拠がいろいろな実験で見付かっています。この薬がくっつく場所が、リンパ球にもくっつくんですが、それだけではなくてオリゴデンドログリアにもアストログリアにも神経細胞にもくっつく、そういう受容体というものが存在しているということが分かっていまして、そういうことを元にして実験をいろいろやっていまして動物実験、これは培養の実験ですが、神経脱髄ということを起こして、それと同時に脱髄というものは神経線維のまわりの髄鞘、ミエリンというものがはげた状態ですが、そこへお薬をフィンゴリモドを投与しますと、そのもう一回まき直すのが可能になると、使わなかったらいつまで経ってもこういう神経線維の脱髄はそのままですけれど、お薬を脱髄と同時にこのお薬を投与しますと赤いのが髄鞘、ミエリンなのですが赤いのが増えるということが培養で証明されていますし、動物実験でも同じようなことが証明されています。
もっと人間での直接的データが無いかということですがそれは脳萎縮進行に対する効果このお薬はいままでのインターフェロンでも脳萎縮はある程度抑制します。
だいたい2年くらいおっかけますと、効果が明らかになってくる薬がいままでもあるんですが、 いくら研究してもうまく証明できないそういうお薬ですね。インターフェロンの中にもそういうものがありまして、いずれにしてもそれほど効果が強くないなあということだったんですが、このお薬は半年で脳萎縮を抑える効果が証明できたというので、いままで2年かかったものにくらべまして半年で証明できたということはかなり有効性が高いというふうに考えられています。
脳萎縮というのは人間だれでも起きるんです、年齢加齢現象でしてこれが正常に比べて下へ落ちているのがきついほどこれは本物があたらなかった人と本物があたった人、だれでも一定程度起きますので、多発性硬化症の患者さんではそれが早くなる。脳が早く縮んでいくということなんですがそれがかなり抑える効果がこのお薬を飲んでいる方にはあるということが証明されています。
-----続く-----